Как выглядит сульфат меди
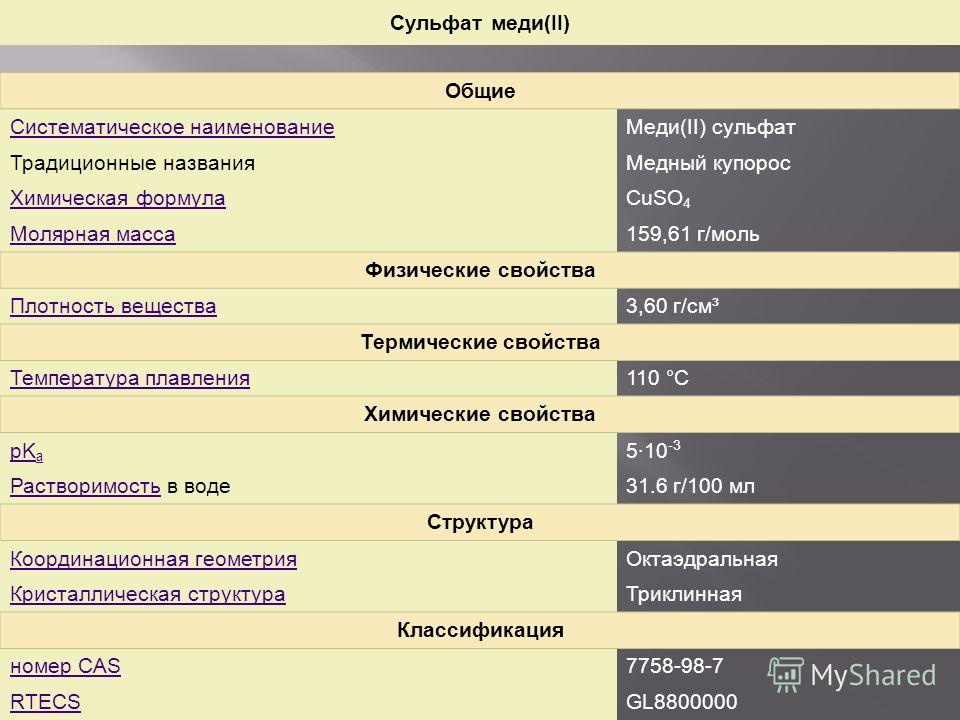
Сульфат меди(II) Общие Систематическое наименование Меди(II) сульфат Традиционные названия Медный купорос Химическая формулаCuSO 4 Молярная масса 159,61 г/моль Физические свойства Плотность вещества 3,60 г/см³ Термические свойства Температура плавления 110 °C Химические свойства pK a 5·10 -3 Растворимость Растворимость в воде 31.6 г/100 мл Структура Координационная геометрия Октаэдральная Кристаллическая структура Триклинная Классификация номер CAS RTECSGL
Использование бронзы преобладало таким образом в период истории человечества, который в конечном итоге обозначил себя «Эпоха бронзы». Переходный период между неолитом и бронзовым веком назывался халколитическим периодом, предел которого указывает на переход от предыстории к истории.
Кристаллизация сульфата меди. Кристаллизация представляет собой процесс отделения твердого вещества от растворения. Поскольку концентрация твердого вещества возрастает выше точки насыщения, избыток твердого вещества отделяется как кристаллы. Этот процесс часто используется в химии для очистки твердого вещества, что является необходимой операцией для тех физиологических растворов, которые имеются в продаже в виде небольших порошков или кристаллов и которые должны быть получены в виде более крупных кристаллов.
Сульфат меди(II) (CuSO 4) бесцветные кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения.CuSO

Его безводная форма, которую можно получить, осторожно нагревая гидрат, является белой. В промышленном отношении он получается из медных руд или под действием концентрированной серной кислоты на чистой меди. Из-за его действия бактерицид и альгицид используются для очистки воды. Таким образом, в минимальных пропорциях он добавляется к питьевой воде для уничтожения водорослей, которые развиваются в водоемах. Он также широко используется в сельском хозяйстве как фунгицид и инсектицидные составы. Его использование в качестве пигмента в древесине или в текстильной и кожаной обработке является другим использованием этого вещества.
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.) При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO 4 · 3H 2 O (этот процесс, то есть выветривание частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO 4 · H 2 O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650°С:выветривание CuSO 4 (t) CuO + SO 2 + O 2 Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5· степень гидролизаpHКонстанта диссоциации С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na 2 ·6H 2 O. Окрашивает огонь в зелёный цвет.зелёный цвет

Сульфат меди кристаллизуется в триклинной системе, основной формой которой является наклонная призма с прямоугольным основанием. Для получения более полной информации о простых экспериментах, которые могут быть выполнены с сульфатом меди, можно ознакомиться.
Журнал «Эврика» по преподаванию и распространению наук, 3, с. 467. На следующем видео показан основной процесс очистки и перекристаллизации сульфата меди. Следующее видео показывает способ получения кристалла пентагидрата сульфата меди из пересыщенного раствора указанной соли.

Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений. Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.этанола Наибольшее количество непосредственно применяемого CuSO 4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком от грибковых заболеваний и виноградной тли.бордосской смесиизвестковым молоком виноградной тли

Если плеер не работает, видеоролик. Листья растений - это органы, предназначенные для газа, но они также могут быть местом, где обеспечивается жизнь растений за пределами растения. Экстра-цветущее растение понимает потребление и использование минеральных питательных веществ, применяемых к надземным частям растений в виде водных растворов. В литературе термин «лиственное питание» обычно используется, потому что наиболее применяемый раствор для липосакции находится на листьях, где добавляется наибольшее количество жизни.
Также известно, что другие растительные части растения, включая фрукты, способны поглощать питательный раствор. Вышеупомянутый тип питания следует рассматривать как дополнительное питание, которое позволяет оперативно корректировать питательный статус растения, как по визуальным показаниям, особенно на основе химического анализа растений.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а так же для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.растворгниения Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.красокэлектролитических ацетатного волокна В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).пищевой промышленностипищевой добавки В природе изредка встречается минерал Халькантит, состав которого близок к CuSO 45H 2 Oминерал Халькантит

Исключительное питание не может быть полностью заменено корневыми культурами, поскольку количество живых животных, взятых на заводе, невелико. Было показано, что растения, посвященные этому типу пищи, ориентированы на развитие, а создание генеративных организмов строго ограничено. Преимущество отключений заключается в том, что взаимодействие между ионами, которые при нанесении на почву могут быть существенно затронуты их приемлемостью и, следовательно, эффективностью подаваемых кормов. Применение травы также может быть объединено с гербицидом, пестицидами и морфинагуляторами.
Реферат на тему:
Сульфат меди(II)
План:
-
Введение
- 1 Строение кристаллогидрата
- 2 Нахождение в природе
- 3 Получение
- 4 Очистка
- 5 Свойства
- 6 Применение
Введение
Сульфат меди CuSO 4 · 5H 2 O
Сульфат меди(II) (CuSO 4) - белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O - медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения.
Основным препятствием для входа животных в надземные части растений является кутикула, покрывающая внешние клеточные стенки эпидермальных клеток, включая трихомы и внешние стенки соседних клеток с дыхательной полостью десен. Механизм входа растений в растения характеризуется тем, что поверхность листьев, на которых прилипает наибольшее количество раствора, покрыта кутикулой, чтобы защитить ее от испарения воды. Контроль поверхности листа, что стало возможным благодаря добавлению моющих средств к раствору удобрений, распространяется, чтобы обеспечить контакт раствора с листьями эпидермальной части листа.
1. Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO 4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
После прохождения конкоидных барьеров животные входят в так называемое свободное пространство, которое включает в себя интермические пространства клеточных стенок и межклеточные пространства. Свободное пространство может рассеять жизнь в более глубокие слои мезофилла, подобно живым в открытом пространстве листьев ксилима из корневых камней, и это обеспечивает приемлемость листва, применяемого ко всем клеткам мезофилла. Эту фазу можно рассматривать как пассивный доход животных, не связанных с метаболизмом.
Однако на открытых просторах животные возвращаются к поверхности листьев и могут быть смыты дождем или грязью. Животные участвуют в метаболических процессах только после разрыва плазмы, которая является активной частью клетки. В лиственном применении скота в свободное пространство мезофилла применяются только корма для листьев.
2. Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO 4 ∙ 5H 2 O
3. Получение
Получают в промышленности: растворением Cu и медных отходов в разб. H 2 SO 4 при продувании воздуха; растворением CuO в H 2 SO 4 ; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.
Фолликулярные пищевые добавки накапливаются в увеличенном количестве листьев, что может временно уменьшить потребление почвы и в то же время увеличить потребление других жизней через корневую систему в результате метаболических изменений. Скорость индивидуального поглощения в течение жизни очень изменчива. Катионы проникают через мембраны быстрее, чем анионы. Листья растений могут поглощать все основные питательные вещества и микроскопы с учетом скорости, перечисленных в таблице.
Скорость поглощения отдельных листьев листьев растений. Скорость поступления ионов в растение влияет на активность лиственного питания. Принятая растительная жизнь характеризуется разной подвижностью. Поэтому для немобильных животных необходимо повторить осанку или выполнить ее, когда растение больше всего необходимо.
CuO + H 2 SO 4 → CuSO 4 + H 2 O
2Cu + O 2 + 2H 2 SO 4 → 2CuSO 4 + 2H 2 O
В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O
Температура не должна превышать 60 градусов Цельсия так как образуется побочный продукт:
5Cu + 4H 2 SO 4 → 3CuSO 4 + Cu 2 S + 2H 2 O
4. Очистка
Обычно технический сульфат меди загрязнен сульфатом железа (II). Реактив Ч. Д. А. не содержит ионов Fe 2+ . Реактив загрязнен изоморфически и его невозможно очистить простой перекристаллизацией. В нашем случае можно окислить Fe 2+ до Fe 3+ кипячением полученного раствора сульфата меди с PbO 2 . Fe 2 (SO 4) 3 не формирует изоморфическую смесь с сульфатом меди. После кипячения раствор фильтруют. А потом кристаллизацией получают чистый сульфат меди.
Абсорбция и относительная подвижность лиственных животных. Скорость поглощения жизни зависит от целого набора условий. Он решает анатомо-морфологическую структуру листьев, толщину кутикулы, листьев и растений. Используя фолиевую кислоту, можно предотвратить переливание земли и снизить риск нанесения ущерба окружающей среде. Однако увеличивается стоимость оплодотворения.
Активность лиственного питания зависит от концентрации и дает решение, которое не может быть слишком высоким для предотвращения повреждения листьев. Для макро-биологических агентов рекомендуются 2% -ные растворы с концентрацией от 0, 1 до 0, 5% для микробиогенных элементов. Реакция раствора должна быть почти нейтральным значением рН. Значения оптимальной концентрации раствора для некоторых культур приведены в таблице.
5. Свойства
Растворимость CuSO 4 , г/100 г H 2 O
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO 4 · 3H 2 O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO 4 · H 2 O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
Значимые значения также имеют внешние факторы: влажность, температура, свет. Относительная влажность воздуха увеличивается, оставляя раствор на поверхности листьев дольше, а количество листьев увеличивается. После испарения воды при более высокой температуре ионизация ограничена и может также возникать.
Технические характеристики, параметры: Содержание меди: мин. 23, 5% Содержание железа: не более 0, 2%. Сульфат меди, известный тривиальным, как сульфат меди, как ранее медный купорос является общим соединением меди. В безводном состоянии образуется белый порошок, который поглощает голубую воду. Поэтому он используется для доказательства воды в органических жидкостях или в качестве сушилок.
2CuSO 4 →(t) 2CuO + 2SO 2 + O 2
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5×10 −3 .
Голубая скала технически является самой важной медной солью. Для вашего интереса: как создать синие скалы - Инструкции. Создание насыщенного раствора медного купороса: вода, тепло до около 50 градусов по Цельсию и растворить медный купорос в нем до тех пор, прекращении не растворится.
Когда он прекратит растворение, вылейте раствор в другой контейнер и дайте ему остыть спонтанно. При охлаждении начинают образовываться кристаллы. Когда раствор охлаждается до температуры окружающей среды, дайте ему постоять в течение нескольких дней. Вода будет испаряться из раствора, и кристаллы будут продолжать расти.
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na 2 ·6H 2 O.
Окрашивает огонь в зелёный цвет.
6. Применение
Кристаллы сульфата меди (II), выращенные в домашних условиях
Монокристалл сульфата меди (II), выращенный в домашних условиях
Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO 4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком - от грибковых заболеваний и виноградной тли.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Данный реферат составлен на основе статьи из русской Википедии . Синхронизация выполнена 12.07.11 18:55:08
Похожие рефераты:
