Раствор сернокислой меди
Реферат на тему:
Сульфат меди(II)
План:
-
Введение
- 1 Строение кристаллогидрата
- 2 Нахождение в природе
- 3 Получение
- 4 Очистка
- 5 Свойства
- 6 Применение
Введение
Сульфат меди CuSO 4 · 5H 2 O
Сульфат меди(II) (CuSO 4) - белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O - медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения.
1. Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO 4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
2. Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO 4 ∙ 5H 2 O
3. Получение
Получают в промышленности: растворением Cu и медных отходов в разб. H 2 SO 4 при продувании воздуха; растворением CuO в H 2 SO 4 ; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.
CuO + H 2 SO 4 → CuSO 4 + H 2 O
2Cu + O 2 + 2H 2 SO 4 → 2CuSO 4 + 2H 2 O
В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
Cu + 2H 2 SO 4 → CuSO 4 + SO 2 + 2H 2 O
Температура не должна превышать 60 градусов Цельсия так как образуется побочный продукт:
5Cu + 4H 2 SO 4 → 3CuSO 4 + Cu 2 S + 2H 2 O
4. Очистка
Обычно технический сульфат меди загрязнен сульфатом железа (II). Реактив Ч. Д. А. не содержит ионов Fe 2+ . Реактив загрязнен изоморфически и его невозможно очистить простой перекристаллизацией. В нашем случае можно окислить Fe 2+ до Fe 3+ кипячением полученного раствора сульфата меди с PbO 2 . Fe 2 (SO 4) 3 не формирует изоморфическую смесь с сульфатом меди. После кипячения раствор фильтруют. А потом кристаллизацией получают чистый сульфат меди.
5. Свойства
Растворимость CuSO 4 , г/100 г H 2 O
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO 4 · 3H 2 O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO 4 · H 2 O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
2CuSO 4 →(t) 2CuO + 2SO 2 + O 2
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5×10 −3 .
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na 2 ·6H 2 O.
Окрашивает огонь в зелёный цвет.
6. Применение
Кристаллы сульфата меди (II), выращенные в домашних условиях
Монокристалл сульфата меди (II), выращенный в домашних условиях
Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO 4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком - от грибковых заболеваний и виноградной тли.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Данный реферат составлен на основе статьи из русской Википедии . Синхронизация выполнена 12.07.11 18:55:08
Похожие рефераты:
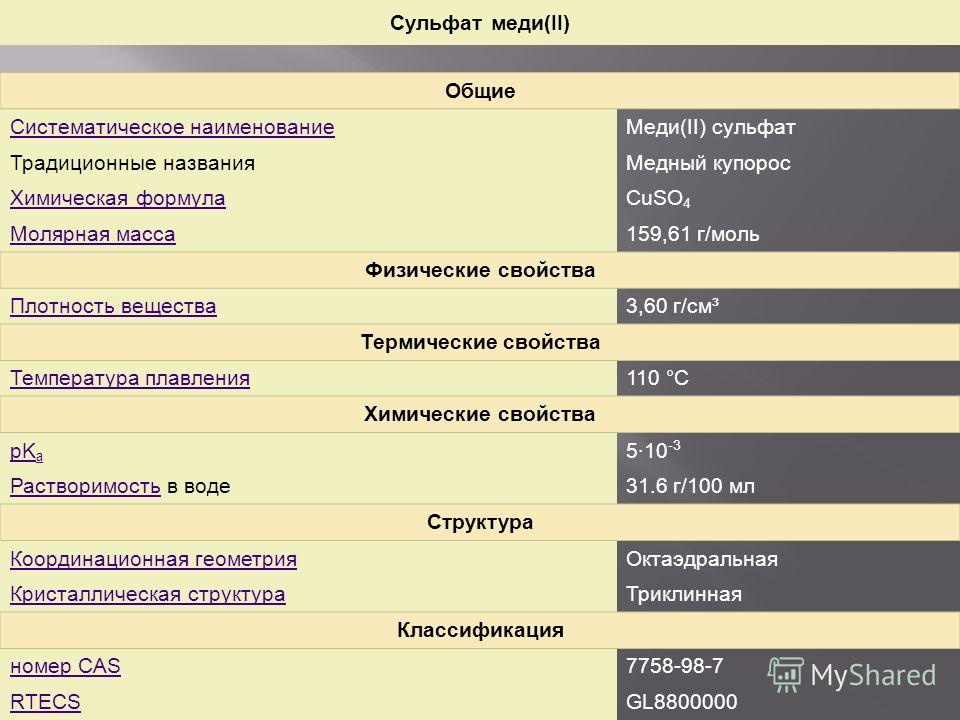
Сульфат меди(II) Общие Систематическое наименование Меди(II) сульфат Традиционные названия Медный купорос Химическая формулаCuSO 4 Молярная масса 159,61 г/моль Физические свойства Плотность вещества 3,60 г/см³ Термические свойства Температура плавления 110 °C Химические свойства pK a 5·10 -3 Растворимость Растворимость в воде 31.6 г/100 мл Структура Координационная геометрия Октаэдральная Кристаллическая структура Триклинная Классификация номер CAS RTECSGL
Сульфат меди(II) (CuSO 4) бесцветные кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения.CuSO

Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.) При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO 4 · 3H 2 O (этот процесс, то есть выветривание частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO 4 · H 2 O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650°С:выветривание CuSO 4 (t) CuO + SO 2 + O 2 Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5· степень гидролизаpHКонстанта диссоциации С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na 2 ·6H 2 O. Окрашивает огонь в зелёный цвет.зелёный цвет


Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений. Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.этанола Наибольшее количество непосредственно применяемого CuSO 4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком от грибковых заболеваний и виноградной тли.бордосской смесиизвестковым молоком виноградной тли

В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а так же для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.растворгниения Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.красокэлектролитических ацетатного волокна В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).пищевой промышленностипищевой добавки В природе изредка встречается минерал Халькантит, состав которого близок к CuSO 45H 2 Oминерал Халькантит

